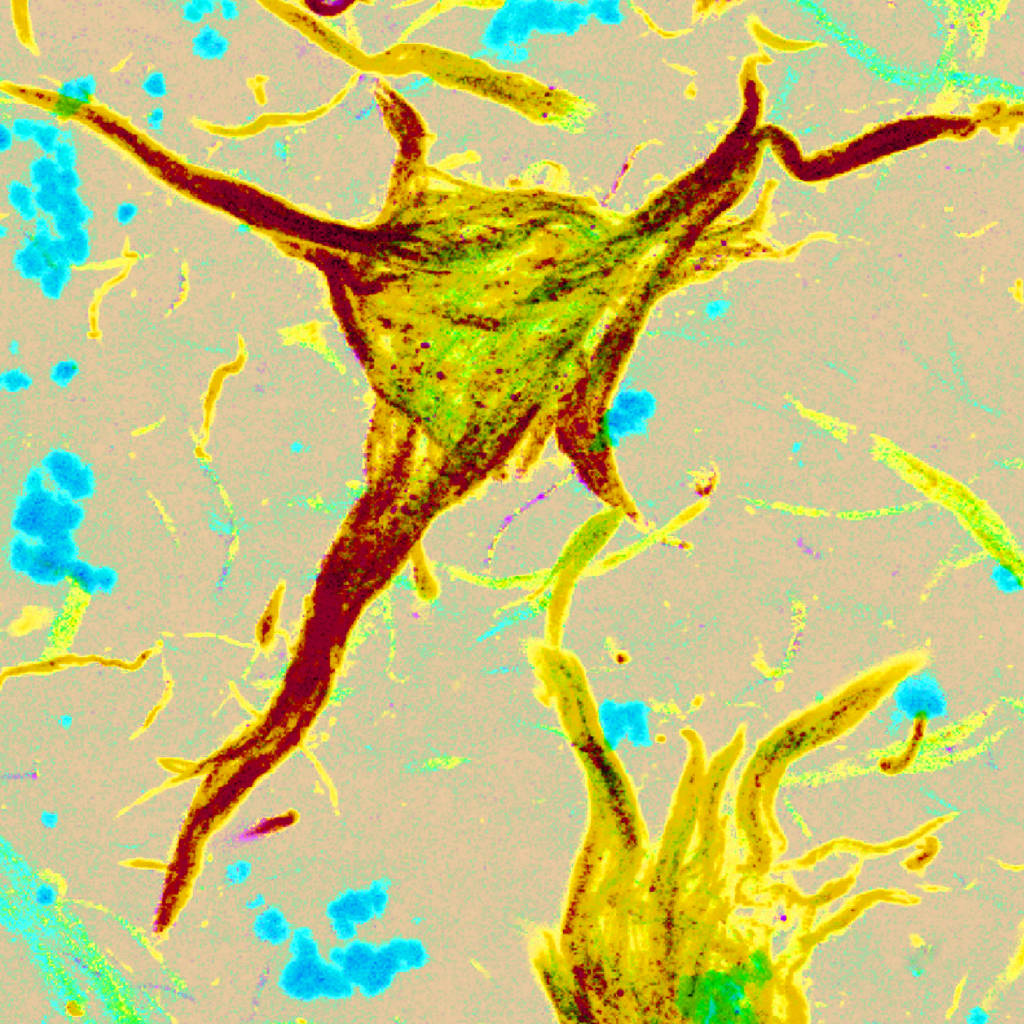
Hallazgo. Lo que hace la neurona es acumular y agregar la proteína tau fosforilada como un mecanismo de protección.
Un artículo que documenta el truncamiento de la proteína tau, la cual podría desencadenar la enfermedad de Alzheimer, que realizó la entonces becaria del Conacyt, la mexicana Paola del Rosario Flores Rodríguez, dio la vuelta al mundo.El texto "La relación entre el truncamiento y la fosforilación en la terminal-C de la proteína tau en los filamentos helicoidales pareados de la enfermedad de Alzheimer", se publicó en la prestigiada revista "Fronteras en Neurociencias" y, recientemente, se incluyó en el libro electrónico "Mecanismos de Neuroprotección Innata".
En una entrevista al Conacyt, Flores Rodríguez dijo que es importante encontrar un biomarcador específico para la enfermedad de Alzheimer.
El objetivo, agregó, es poder desarrollar fármacos que pudiesen detener o frenar la acumulación y formación de fragmentos de la molécula de tau que son de una toxicidad alta.
La joven investigadora comentó que en este estudio se analizaron los patrones de agregación y expresión de la proteína tau en el cuerpo de la neurona del hipocampo de cerebros, en los pacientes con Alzheimer.
"Con nuestro análisis inmunohistoquímico, hemos podido sugerir que la proteína tau puede presentar dos vertientes, una de toxicidad y otra de protección", mencionó la investigadora.
Estos dos eventos: la proteólisis (truncamiento) e hiperfosforilación de la proteína tau, son conocidos porque se asocian a la génesis de los filamentos helicoidales apareados, y son altamente insolubles en el cuerpo de la neurona.